Як знайти масову частку речовини в суміші
Ключові слова конспекту: масова частка речовини в суміші або розчині, молярна частка речовини, об’ємна частка речовини, масова частка елемента в з’єднанні, маса елемента, масова частка елемента.
Масову частку речовини в суміші або розчині обчислюють як відношення маси речовини, що входить до складу суміші, до маси всієї суміші. Масову частку часто висловлюють у відсотках. Для цього відношення маси речовини до маси суміші множать на 100%:
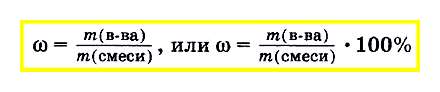
Аналогічно об’ємну частку речовини обчислюють як відношення обсягу речовини до об’єму суміші, а молярна частку речовини. як відношення кількості речовини одного з компонентів суміші до суми кількостей речовин всіх компонентів суміші:
Масову частку елемента в з’єднанні обчислюють як відношення маси елемента, що входить до складу даного з’єднання, до маси всього з’єднання:
Знаючи молекулярну формулу сполуки, масу елемента, що входить в його склад, обчислюють як добуток молярної маси елемента на число атомів цього елемента в з’єднанні.
В цьому випадку масову частку елемента в з’єднанні розраховують як відношення цієї величини до молярної маси всього з’єднання:
Цитати з посібника «Завдання з хімії 8-9 кл.» (Авт. О.С. Габріелян і ін.) Використані в навчальних цілях. Посилання на покупку книги вказана в кінці конспекту.
Приклади РІШЕННЯ ЗАДАЧ
Завдання № 1. 25 г оксиду магнію змішали з 35 г оксиду алюмінію. Визначте масову частку оксиду магнію в даній суміші.
Відповідь. ω (MgO) = 0,417, або 41,7%.
Завдання № 2. Обчисліть об’ємну частку азоту в суміші газів, що містить 32 л азоту, 48 л вуглекислого газу, 36 л гелію і 14 л водню.
Завдання № 3. Обчисліть молярну і масову частку (у%) оксиду вуглецю (II) в суміші, що містить 16,8 л (н. У.) Оксиду вуглецю (II) і 13,44 л (н. У.) Оксиду вуглецю (IV).
Відповідь. χ (СО) = 55,56%, ω (СО) = 44,3%.
Завдання № 4. У воді розчинили 15 г хлориду натрію. Обчисліть масу отриманого розчину, якщо масова частка солі в ньому дорівнює 5%.
Відповідь: m (розчину) = 300 г.
Завдання № 5. Зразок сплаву міді з цинком має масу 75 г. Масова частка міді в цьому сплаві дорівнює 64%. Визначте масу цинку в даному зразку.
Відповідь. m (Zn) = 27 г.
[Highlight] Завдання № 6. [/ Highlight] Об’ємна частка аміаку в суміші з киснем дорівнює 40%. Обчисліть щільність даної суміші по повітрю.
Відповідь. Dвозд (суміші) = 0,896.
Масова частка елемента в складі речовини
Завдання № 7. Знайдіть масову частку кисню в фосфаті натрію.
Відповідь. ω (O) = 39%.
[Highlight] Завдання № 8. [/ Highlight] Визначте масову частку фосфору в суміші, що містить 55 г фосфату натрію і 70 г дигідрофосфату натрію.
Відповідь. ω (Р) = 22,77%
[Highlight] Завдання № 9. [/ Highlight] Масова частка сірки в технічному сульфате натрію дорівнює 20,48%. Розрахуйте масову частку домішок в даному продукті (в%).
Завдання № 10. Щільність суміші оксиду азоту (II) і оксиду азоту (IV) за воднем дорівнює 17,8. Знайдіть масову частку оксиду азоту (IV) в даній суміші.
Відповідь. ω (NO2) = 45,2%.
Рішення задач з часткою речовини в суміші, в з’єднанні. Виберіть подальші дії:
§ 14. Масова частка речовини в розчині
Жарт відома, але давайте подивимося на неї очима хіміка. Навряд чи вам сподобається такий «чай в гостях». Вже дуже солодкий він буде через непомірного вмісту цукру! розчиненої речовини в розчині хіміки називають концентрацією.
Концентрацію речовини можна висловлювати різними способами. До речі, число ложечок на склянку води. спосіб цілком прийнятний, але тільки для кухні. Важко уявити собі хіміка, готується розчин таким чином.
Один з найпоширеніших способів вираження концентрації. це масова частка речовини в розчині.
| Масовою часткою речовини в розчині називають відношення маси розчиненої речовини до маси розчину. |
Чи не правда, дуже схоже на об’ємну частку? Так воно і є, адже будь-яка частка, як ви вже знаєте. це відношення частини чого-небудь до цілого. Як і масова частка елемента в складній речовині, масова частка речовини в розчині позначається латинською буквою w і може приймати значення від 0 до 1 (або від 0 до 100%). Вона показує, яка частина маси розчину доводиться на розчинена речовина. І ще: масова частка речовини в процентах чисельно дорівнює масі розчиненої речовини в 100 г розчину. Наприклад, в 100 г 3%.го розчину оцту міститься 3 г чистої оцтової кислоти.
Найпростіші розчини складаються з двох компонентів. Перший. це розчинник. Для нас більш звичні рідкі розчини, значить, розчинник в них. рідка речовина. Найчастіше це вода.
Другий компонент розчину. розчинена речовина. Їм може бути й газоподібне, і рідке, і тверда речовина.
Маса розчину складається з маси розчинника і маси розчиненої речовини, т. Е. Вірно вираз:
m (розчину) = m (розчинника) m (розчиненої речовини).
Припустимо, масова частка розчиненої речовини дорівнює 0,1, або 10%. Значить, що залишилися 0,9, або 90%. це масова частка розчинника.
Масова частка розчиненої речовини широко використовується не тільки в хімії, але і в медицині, біології, фізики, та й у повсякденному житті. Як невелика ілюстрації сказаного розглянемо рішення деяких завдань прикладного характеру.
Завдання 6. Перед посадкою насіння томатів дезінфікують (протруюють) 1%.м розчином КМnO4 (марганцівки). Яку масу такого розчину можна приготувати з 0,25 г КМnO4?
Завдання 7. У медицині широко застосовують так звані фізіологічні розчини, зокрема розчин кухонної солі з масовою часткою розчиненої речовини 0,9%. Розрахуйте маси солі і води, необхідні для приготування 1500 г фізіологічного розчину.
Чи відрізняються властивості розчинів від властивостей компонентів, що утворюють ці гомогенні суміші?
За допомогою домашнього експерименту (завдання 9 до цього параграфу) вам буде неважко переконатися в тому, що розчин замерзає при більш низькій температурі, ніж чистий розчинник. Наприклад, морська вода (рис. 78) починає замерзати при температуре.1,9 ° С, в той час як чиста вода кристалізується при Про ° С.
Мал. 78.
Морська вода. це теж розчин з масовою часткою розчинених солей близько 3,5%
Запитання і завдання
- Що таке масова частка розчиненої речовини? Порівняйте поняття «об’ємна» і «масова частка» компонентів суміші.
- Масова частка йоду в аптечній йодної настоянки становить 5%. Яку масу йоду і спирту потрібно взяти, щоб приготувати 200 г настоянки?
- У 150 г води розчинили 25 г кухонної солі. Визначте масову частку солі в отриманому розчині.
- У 200 г столового оцту міститься б г оцтової кислоти. Визначте масову частку кислоти в столовому оцті.
- Знайдіть масу води і лимонної кислоти, необхідних для приготування 50 г 5%.го розчину.
- З 240 г 3%.го розчину питної соди випарили 80 г води. Знайдіть масову частку соди в отриманому розчині.
- До 150 г 20%.го розчину цукру додали 30 г цукру. Знайдіть масову частку речовини в отриманому розчині.
- Змішаємо два розчину сірчаної кислоти: 80 г 40%.го і 160 г 10%.го розчину. Знайдіть масову частку кислоти в отриманому розчині.
- П’ять чайних ложок повареної солі (повних, з гіркою) розчиніть в 450 г (450 мл) води. З огляду на, що маса солі в кожній ложці приблизно 10 г, розрахуйте масову частку солі в розчині. Візьміть дві однакові пластикові пляшки об’ємом 0,5 л. У 1-ю налийте отриманий розчин, а в 2-у. водопровідну воду. Помістіть пляшки в морозильну камеру холодильника. Загляньте в холодильник приблизно через годину. Яка рідина почне замерзати раніше? В якій пляшці вміст раніше перетвориться на лід? Зробіть висновок.
Практична робота
Приготування розчину із заданою масовою часткою розчиненої речовини
Мета роботи полягає в приготуванні розчину із заданою масовою часткою шляхом розчинення розрахованої маси твердої речовини в певному обсязі води.
Розрахуйте масу твердої речовини, необхідного для приготування розчину, відповідно до вашого варіанта завдання (табл. 3). На вагах відміряйте розраховану масу твердої речовини і перенесіть його в хімічний стакан.
Таблиця 3
Варіанти завдань для виконання практичної роботи № 3
Розрахуйте масу води, необхідної для приготування розчину. Оскільки щільність води дорівнює 1 г / мл, розрахована вами маса чисельно дорівнює її обсягу води. За допомогою мірного циліндра відміряйте обчислений обсяг води і приплив його до речовини в склянці. Перемішуючи вміст склянки скляній паличкою, добийтеся повного розчинення речовини у воді.
Як знайти масову частку речовини
Необхідно визначити масову частку речовини, речовина знаходиться у вигляді суміші. Спочатку кладемо на терези сама речовина. Отримали масу речовини. Знаючи певну масу речовини в суміші ми з легкістю отримаємо його масову частку. Наприклад є 170г. води. У них знаходиться 30 грам вишневого соку. Загальна маса = 17030 = 230 грам. Поділимо масу вишневого соку до загальної маси суміші: 30/200 = 0.15 або 15%.
Як знайти масову частку?
Навіть в одному грамі речовини може міститися до тисячі різних сполук. Кожне з’єднання відповідає за певну властивість речовини, а буває так, що це не певна речовина, а суміш. У будь-якому випадку на виробництві часто виникає ситуація утилізації хімічних відходів і завдання використання вторинної сировини. Саме хімічні реакції, що дозволяють знайти і виділити певну речовину є головними. Але для цього треба спочатку дізнатися як знайти масову частку.
Поняття масової частки речовини відображає його і концентрацію в складній хімічною структурою, будь то суміш або сплав. Знаючи загальну масу сплаву або суміші, можна знайти маси складових їх речовин, за умови, що відомі їхні масові частки. Як знайти масову частку, формула зазвичай виражається у вигляді дробу: масова частка речовини маса речовини / маса всієї суміші.
Давайте проведемо невеличкий експеримент! Для цього нам знадобляться періодична таблиця хімічних елементів ім. Менделєєва, ваги і калькулятор.
Як знайти масову частку розчину
Рішення даної проблеми може знадобитися при визначенні концентрації харчових розчинів (оцет) або лікарських препаратів. Дана маса розчину KOH, він же гідроксид калію, масою в 400 грам. KOH (маса самого речовини) складає 80 грам. Необхідно знайти масову частку жовчі в отриманому розчині. Формула знаходження рішення: KOH (маса розчину гідроксиду калію) 300 г, маса розчиненої речовини (KOH) 40 р Знайдіть KOH (масову частку лугу) в отриманому розчині, t- масова частка. m- маса, t (речовини) = 100% m (речовини) / m (розчину (речовини). Таким чином KOH (масова частка розчину гідроксиду калію): t (KOH) = 80 г / 400 г х 100% = 20%.
Як знайти масову частку вуглецю в вуглеводні
Для цього використовуємо таблицю Менделєєва. Шукаємо речовини в таблиці. У таблиці наведено атомна маса елементів. 6 вуглеців з атомною масою 12 і 12 відрядив з атомною масою рівною 1. m (C6H12) = 6 х 12 12 х 1 = 84 г / моль, ω (С) = 6 m1 (С) / m (C6H12) = 6 х 12/84 = 85%
Визначення масової частки на виробництвах проводиться в спеціальних хімічних лабораторіях. Для початку береться невеликий зразок, на який відчувають різні хімічні реакції. Або впроваджують лакмусові папірці, які можуть показати наявність того чи іншого компонента. Після з’ясування первісної структури речовини можна починати виділення компонентів. Це досягається за рахунок простих хімічних реакцій, коли одна речовина контактує з іншим і виходить нове, можливий осад. Існують і більш просунуті способи, такі як електроліз, нагрівання, охолодження, випарювання. Для подібних реакцій потрібно велике промислове обладнання. Виробництво, звичайно, важко назвати екологічно чистим, проте сучасні технології обробки відходів дозволяють мінімізувати навантаження на природу.
Що таке масова частка?
Отже, для початку з’ясуємо, що таке масова частка. Як знаходити масову частку елемента в речовині, відповість будь-який хімік, так як вони часто вживають цей термін при вирішенні завдань або під час перебування в лабораторії. Звичайно, адже її розрахунок. їх повсякденна задача. Щоб отримати певну кількість того чи іншого речовини в лабораторних умовах, де дуже важливий точний розрахунок і всі можливі варіанти результату реакцій, необхідно знати всього пару простих формул і розуміти суть масової частки. Тому ця тема так важлива.
Цей термін позначається символом “w” і читається як “Omega”. Він виражає відношення маси даної речовини до загальної маси суміші, розчину або молекули, виражається дробом або у відсотках. Формула розрахунку масової частки:
Ми знаємо, що m = nM, де m. маса; n. кількість речовини, виражене в одиницях виміру моль; M. молярна маса речовини, виражена в грам / моль. Молярна маса чисельно дорівнює молекулярній. Тільки молекулярна маса вимірюється в атомних одиницях мас або а. е. м. Така одиниця виміру дорівнює одній дванадцятій частці маси ядра вуглецю 12. Значення молекулярної маси можна знайти в таблиці Менделєєва.
Кількість речовини n потрібного об’єкту в даній суміші, так само індексу, помноженому на коефіцієнт при даному з’єднанні, що дуже логічно. Наприклад, щоб розрахувати кількість атомів в молекулі, треба дізнатися, скільки атомів потрібного речовини знаходиться в 1 молекулі = індекс, і помножити це число на кількість молекул = коефіцієнт.
Не варто боятися таких громіздких визначень або формул, в них простежується певна логіка, зрозумівши яку, можна навіть самі формули не вчити. Молярна маса M дорівнює сумі атомних мас Ar даної речовини. Нагадаємо, що атомна маса. маса 1 атома речовини. Тобто вихідна формула масової частки:
З цього можна зробити висновок, що якщо суміш складається з однієї речовини, масову частку якого треба вирахувати, то w = 1, так як маса суміші і маса речовини збігаються. Хоча суміш апріорі не може складатися з одного речовини.
Так, з теорією розібралися, але як знаходити масову частку елемента в речовині на практиці? Зараз все покажемо і розповімо.
Рішення:
Візьмемо 1 моль FeSO47 H2O, тоді дізнаємося кількість заліза, помноживши коефіцієнт заліза на його індекс: 11 = 1. Дан 1 моль заліза. Дізнаємося його масу в речовині: з значення в таблиці Менделєєва видно, що атомна маса заліза 56 а. е. м. = 56 грам / моль. В даному випадку Ar = M. Отже, що m заліза = nM = 1 моль 56 грам / моль = 56 г.
Тепер потрібно знайти масу всієї молекули. Вона дорівнює сумі мас вихідних речовин, тобто 7 моль води і 1 моль сульфату заліза.
m = (n води M води) (n сульфату железаM сульфату заліза) = (7 моль (1216) грам / моль) (1 моль (1 моль56 грам / моль1 моль32 грам / моль 4 моль16 грам / моль) = 126152 = 278 г.
Залишається лише розділити масу заліза на масу сполуки:
Перевірка засвоєного матеріалу. Завдання легкого рівня
Зараз ми розберемо два завдання: легкого і середнього рівня. !
Необхідно дізнатися масову частку заліза в молекулі залізного купоросу FeSO47 H2O. Як вирішити цю задачу? Розглянемо рішення далі.
Завдання середнього рівня
Вирішимо більш складну задачу. У 500 г води розчинено 34 г нітрату кальцію. Потрібно знайти масову частку кисню в отриманому розчині.
♀ «Як знаходити масову частку елемента в речовині? Що це таке? »♂
Що таке масова частка в хімії? Чи знаєте ви відповідь? Як знаходити масову частку елемента в речовині? Сам процес обчислення зовсім не так складний. А ви ще є труднощі в подібних завданнях? Тоді вам посміхнулася удача, ви знайшли цю статтю! Цікаво? Тоді швидше читайте, зараз ви все зрозумієте.
Рішення
Так як при взаємодії Ca (NO3) 2 з водою йде тільки процес розчинення, а з розчину не виділяються продукти реакції, маса суміші дорівнює сумі мас нітрату кальцію і води.
Нам потрібно знайти масову частку кисню в розчині. Звернемо увагу на те, що кисень міститься як в розчиненому речовині, так і в розчиннику. Знайдемо кількість шуканого елемента у воді. Для цього порахуємо моль води за формулою n = m / M.
n води = 500 г / (1216) грам / моль = 27.7777≈28 моль
З формули води H2O знайдемо, що кількість кисню = кількості води, тобто 28 моль.
Тепер знайдемо кількість кисню в розчиненому Ca (NO3) 2. Для цього дізнаємося кількість самого речовини:
n Ca (NO3) 2 = 34 г / (4012 (14163)) грам / моль≈0.2 моль.
n Ca (NO3) 2 відноситься до n O як 1 до 6, що випливає з формули сполуки. Значить, n O = 0.2 моль6 = 1.2 моль. Сумарно кількість кисню одно 1.2 моль28 моль = 29.2 моль
m розчину = m води m Ca (NO3) 2 = 500 Г34 г = 534 г.
Залишилося тільки саме обчислення масової частки хімічного елемента в речовині:
Сподіваємося, що ми зрозуміло пояснили вам то, як знаходити масову частку елемента в речовині. Дана тема зовсім не складна, якщо в ній добре розібратися. Бажаємо вам удачі і успіхів в майбутніх починаннях.
Перевірка засвоєного матеріалу. Завдання легкого рівня
Зараз ми розберемо два завдання: легкого і середнього рівня. !
Необхідно дізнатися масову частку заліза в молекулі залізного купоросу FeSO47 H2O. Як вирішити цю задачу? Розглянемо рішення далі.
Завдання середнього рівня
Вирішимо більш складну задачу. У 500 г води розчинено 34 г нітрату кальцію. Потрібно знайти масову частку кисню в отриманому розчині.
Як знаходити масову частку елемента в речовині? Що це таке?
Що таке масова частка в хімії? Чи знаєте ви відповідь? Як знаходити масову частку елемента в речовині? Сам процес обчислення зовсім не так складний. А ви ще є труднощі в подібних завданнях? Тоді вам посміхнулася удача, ви знайшли цю статтю! Цікаво? Тоді швидше читайте, зараз ви все зрозумієте.
Що таке масова частка?
Отже, для початку з’ясуємо, що таке масова частка. Як знаходити масову частку елемента в речовині, відповість будь-який хімік, так як вони часто вживають цей термін при вирішенні завдань або під час перебування в лабораторії. Звичайно, адже її розрахунок. їх повсякденна задача. Щоб отримати певну кількість того чи іншого речовини в лабораторних умовах, де дуже важливий точний розрахунок і всі можливі варіанти результату реакцій, необхідно знати всього пару простих формул і розуміти суть масової частки. Тому ця тема так важлива.
Цей термін позначається символом “w” і читається як “Omega”. Він виражає відношення маси даної речовини до загальної маси суміші, розчину або молекули, виражається дробом або у відсотках. Формула розрахунку масової частки:
Ми знаємо, що m = nM, де m. маса; n. кількість речовини, виражене в одиницях виміру моль; M. молярна маса речовини, виражена в грам / моль. Молярна маса чисельно дорівнює молекулярній. Тільки молекулярна маса вимірюється в атомних одиницях мас або а. е. м. Така одиниця виміру дорівнює одній дванадцятій частці маси ядра вуглецю 12. Значення молекулярної маси можна знайти в таблиці Менделєєва.
Кількість речовини n потрібного об’єкту в даній суміші, так само індексу, помноженому на коефіцієнт при даному з’єднанні, що дуже логічно. Наприклад, щоб розрахувати кількість атомів в молекулі, треба дізнатися, скільки атомів потрібного речовини знаходиться в 1 молекулі = індекс, і помножити це число на кількість молекул = коефіцієнт.
Не варто боятися таких громіздких визначень або формул, в них простежується певна логіка, зрозумівши яку, можна навіть самі формули не вчити. Молярна маса M дорівнює сумі атомних мас Ar даної речовини. Нагадаємо, що атомна маса. маса 1 атома речовини. Тобто вихідна формула масової частки:
З цього можна зробити висновок, що якщо суміш складається з однієї речовини, масову частку якого треба вирахувати, то w = 1, так як маса суміші і маса речовини збігаються. Хоча суміш апріорі не може складатися з одного речовини.
Так, з теорією розібралися, але як знаходити масову частку елемента в речовині на практиці? Зараз все покажемо і розповімо.
Рішення:
Візьмемо 1 моль FeSO47 H2O, тоді дізнаємося кількість заліза, помноживши коефіцієнт заліза на його індекс: 11 = 1. Дан 1 моль заліза. Дізнаємося його масу в речовині: з значення в таблиці Менделєєва видно, що атомна маса заліза 56 а. е. м. = 56 грам / моль. В даному випадку Ar = M. Отже, що m заліза = nM = 1 моль 56 грам / моль = 56 г.
Тепер потрібно знайти масу всієї молекули. Вона дорівнює сумі мас вихідних речовин, тобто 7 моль води і 1 моль сульфату заліза.
m = (n води M води) (n сульфату железаM сульфату заліза) = (7 моль (1216) грам / моль) (1 моль (1 моль56 грам / моль1 моль32 грам / моль 4 моль16 грам / моль) = 126152 = 278 г.
Залишається лише розділити масу заліза на масу сполуки:
Рішення
Нам потрібно знайти масову частку кисню в розчині. Звернемо увагу на те, що кисень міститься як в розчиненому речовині, так і в розчиннику. Знайдемо кількість шуканого елемента у воді. Для цього порахуємо моль води за формулою n = m / M.
n води = 500 г / (1216) грам / моль = 27.7777≈28 моль
З формули води H2O знайдемо, що кількість кисню = кількості води, тобто 28 моль.
Тепер знайдемо кількість кисню в розчиненому Ca (NO3) 2. Для цього дізнаємося кількість самого речовини:
n Ca (NO3) 2 = 34 г / (4012 (14163)) грам / моль≈0.2 моль.
n Ca (NO3) 2 відноситься до n O як 1 до 6, що випливає з формули сполуки. Значить, n O = 0.2 моль6 = 1.2 моль. Сумарно кількість кисню одно 1.2 моль28 моль = 29.2 моль
m розчину = m води m Ca (NO3) 2 = 500 Г34 г = 534 г.
Залишилося тільки саме обчислення масової частки хімічного елемента в речовині:
Сподіваємося, що ми зрозуміло пояснили вам то, як знаходити масову частку елемента в речовині. Дана тема зовсім не складна, якщо в ній добре розібратися. Бажаємо вам удачі і успіхів в майбутніх починаннях.
Інструкція
Для наочності роздивіться класно звісно кожним вуглець, без якого не було б органіки. Якщо вуглець являє собою чисте речовина (скажімо, алмаз), то його масову частку дозволено хоробро прийняти за одиницю або за 100%. Зрозуміло, алмаз теж містить домішки інших елементів, але в більшості випадків, в настільки дрібних числах, що ними можна знехтувати. А ось в таких модифікаціях вуглецю, як кам’яне вугілля або графіт, зміст домішок досить висока, і таке ігнорування неприйнятно.
Якщо ж вуглець входить до складу важкого речовини, потрібно робити подальшим чином: запишіть точну формулу речовини, після цього, знаючи молярні маси всякого елемента. що входить до його складу, обчисліть точну молярну масу цієї речовини (зрозуміло, з урахуванням «індексу» всякого елемента). Пізніше цього визначити масову частку. поділивши загальну молярну масу елемента на молярну масу речовини.
Скажімо, необхідно виявити масову частку вуглецю в оцтової кислоти. Напишіть формулу оцтової кислоти: СН3СООН. Для спрощення підрахунків перетворіть її в вид: С2Н4О2. Молярна маса цієї речовини складається з молярних мас елементів: 24, 4 32 = 60. Відповідно, масова частка вуглецю в цій речовині обчислюється так: 24/60 = 0,4.
Якщо необхідно обчислити її в процентному співвідношенні, відповідно, 0,4 100 = 40%. Тобто в будь-якому кілограмі оцтової кислоти міститься (приблизно) 400 грам вуглецю.
Зрозуміло, ідеально аналогічним чином можна виявити масові частки всіх інших елементів. Скажімо, масова частка кисню в тій же оцтової кислоти обчислюється так: 32/60 = 0,533 або приблизно 53,3%; а масова частка водню дорівнює 4/60 = 0,666 або приблизно 6,7%.
Для перевірки точності обчислень складіть процентні частки всіх елементів: 40% (вуглець) 53,3% (кисень) 6,7% (водень) = 100%. рахунок зійшовся.
Як визначити масу води
Воду, як і будь-яку рідину, не незмінне дозволено зважити на терезах. Але дізнатися масу води буває потрібно як на деяких виробництвах, так і в звичайних життєвих ситуаціях, від розрахунку резервуарів до вирішення питання, який резерв води ви можете взяти з собою в байдарку або гумовий човен. Для того, щоб обчислити масу води або всякий рідини, розміщеної в той чи інший обсяг, раніше кожного потрібно знати її щільність.
- ваги
- мірний посуд
- Лінійка, рулетка або будь-який інший вимірювальний прилад
- Посудина для переливання води
Інструкція
Для того, щоб визначити масу води в посудині, той, що нереально зважити, потрібно знати два параметри. щільність води (або будь-який інший рідини) і об’єм посудини. Щільність води становить 1 г / мл. Щільність іншої рідини дозволено виявити в особливій таблиці, яка зазвичай буває в довідниках з хімії.
Якщо немає мірного посуду, в яку дозволено перелити воду, обчисліть об’єм посудини, в якому вона знаходиться. Обсяг незмінно дорівнює добутку площі підстави на висоту, і з судинами постій форми традиційно завдань не відображається. Обсяг води в банку буде дорівнює площі круглого підстави на висоту, заповнену водою. Помноживши щільність? на обсяг води V, ви отримаєте масу води m: m =? V.
Зверніть увагу!
Визначити масу дозволено і знаючи число води і її молярну масу. Молярна маса води дорівнює 18, від того що складається з молярних мас 2 атомів водню і 1 атома кисню. MH2O = 2MHMO = 2 116 = 18 (г / моль). m = nM, де m. маса води, n. число, M. молярна маса.
Як визначити масову частку речовини
Масова частка речовини показує його зміст в більше важкою структурі, скажімо, в сплаві або суміші. Якщо звісно загальна маса суміші або сплаву, то знаючи масові частки складових речовин дозволено виявити їх маси. Виявити масову частку речовини, дозволено знаючи його масу і масу кожної суміші. Ця величина, може виражатися в часткових величинах або процентах.
- ваги;
- періодична таблиця хімічних елементів;
- калькулятор.
Як визначити масову частку
Є два варіанти постановки задачі: 1) коли необхідно визначити масову частку елемента в речовині; 2) коли необхідно визначити масову частку розчиненої речовини.
- Потрібно визначити, до якого варіанту відноситься ваша задача. У разі першого варіанта вам буде потрібно таблиця Менделєєва. У разі другого. потрібно знати, що розчин складається з 2-х компонентів: розчиненої речовини і розчинника. І маса розчину дорівнює масам цих 2-х компонентів.
Як виявити масову частку елемента
Що таке масова частка елемента? З самої назви можна зрозуміти, що це величина, яка вказує, в якому співвідношенні знаходяться маса елемента. що входить до складу речовини, і загальна маса цієї речовини. Вона виражається в частках одиниці: відсотках (сотих частках), проміле (тисячних) і т.д. Як можна обчислити масу якого-небудь елементу ?
Інструкція
У разі першого варіанта завдання: По таблиці Менделєєва знаходимо молярну масу речовини. Молярна маса дорівнює сумі ядерних мас елементів, що входять до складу вещества.Скажем, молярна маса (Mr) гідрокісда кальцію Са (ОН) 2: Mr (Са (ОН) 2) = Ar (Ca) (Ar (O) Ar (H) ) 2 = 40 (16 1) 2 = 74.Молярние маси атомів беруться з таблиці Менделєєва.
Обчислюємо масову частку елемента (?), Скажімо кальцію в гидроксиде кальція.Массовая частка дорівнює відношенню ядерної маси елемента до молярної маси речовини:? = Ar: Mr.В випадку гідроксиду кальцію:? (Са) = 40:74 = 0,54. Це масова частка елемента в частках одиниці.
У разі другого варіанту завдання: Визначити, які маси вам дано, а саме: маса розчиненої речовини і маса розчину або маса розчиненої речовини і маса розчинника.
Якщо дані маси розчиненої речовини і розчину, то масова частка дорівнює відношенню маси розчиненої (р.в.) речовини до маси розчину (розчину).? = M (р.в.): M (розчину) Скажімо, якщо маса солі 40 г, а маса розчину 100 г, то? (Солі) = 40: 100 = 0,4. Це масова частка розчиненої речовини в частках одиниці.
Якщо дані маси розчиненої речовини і розчинника, то спочатку потрібно визначити масу розчину. Маса розчину (розчину) дорівнює сумі мас розчиненої речовини (р.в.) і розчинника (р-ля).m (р-ра) = m (р.в.) M (р-ля) Скажімо, якщо маса солі 40 г, а маса води 60 г, то m (розчину) = 40 60 = 100 (г).Після цього обчислюється масова частка розчиненої речовини подібно до попереднього кроку.
Щоб виявити масову частку у відсотках треба помножити масову частку в частках одиниці на 100.?(Са) = 0,54 100 = 54%
Інструкція
Визначте масову частку речовини, яке знаходиться в суміші через маси суміші і самого речовини. Для цього з підмогою ваг визначте маси речовин, що складають суміш або сплав. Після цього складіть їх. Отриману масу прийміть за 100%. Щоб виявити масову частку речовини в суміші, поділіть його масу m на масу суміші M, а підсумок помножте на 100% (?% = (M / M)? 100%). Скажімо, в 140 г води розчиняють 20 г кухонної солі. Щоб виявити масову частку солі, складіть маси цих 2-х речовин М = 14020 = 160 г. Після цього знайдіть масову частку речовини?% = (20/160)? 100% = 12,5%.
Якщо потрібно виявити зміст або масову частку елемента в речовині з знаменитою формулою, скористайтеся періодичної таблиці хімічних елементів. По ній виявіть ядерні маси елементів, які входять до складу речовини. Якщо один елемент зустрічається у формулі кілька разів, помножте його ядерну масу на це число і складіть отримані підсумки. Це буде молекулярна маса речовини. Щоб виявити масову частку всякого елемента в такому речовині, поділіть його масове число в даній хімічній формулі M0 на молекулярну масу даної речовини M. Підсумок множьте на 100% (?% = (M0 / M)? 100%).
Скажімо, визначте масову частку хімічних елементів в мідному купоросу. Мідний купорос (сульфат міді II), має хімічну формулу CuSO4. Ядерні маси елементів, що входять в його склад рівні Ar (Cu) = 64, Ar (S) = 32, Ar (O) = 16, масові числа цих елементів будуть рівні M0 (Cu) = 64, M0 (S) = 32, M0 (O) = 16? 4 = 64, з урахуванням того, що в молекулі міститься 4 атоми кисню. Розрахуйте молекулярну масу речовини, вона дорівнює сумі масових чисел складових молекулу речовин 643264 = 160. Визначте масову частку міді (Cu) в складі мідного купоросу (?% = (64/160)? 100%) = 40%. За таким же тезі можна визначити масові частки всіх елементів в цій речовині. Масова частка сірки (S)?% = (32/160)? 100% = 20%, кисню (О)?% = (64/160)? 100% = 40%. Зверніть увагу на те, що сума всіх масових часток речовини повинна скласти 100%.
Зверніть увагу!
При обчисленні масової частки розчину необхідно чітко визначити, що є розчиненим речовиною, а що розчинником. Частіше кожного розчиненим речовиною є якась сіль, розчинником. вода.
Корисна порада
При обчисленні масової частки незмінно менше число ділитися на більше, тому що масова частка незмінно поменше одиниці.
Як розрахувати концентрацію розчину
У створенні цієї статті брала участь наша досвідчена команда редакторів і дослідників, які перевірили її на точність і повноту.
Команда контент-менеджерів wikiHow ретельно стежить за роботою редакторів, щоб гарантувати відповідність кожної статті нашим високим стандартам якості.
Кількість джерел, використаних в цій статті: 12. Ви знайдете їх список внизу сторінки.
Кількість переглядів цієї статті: 155 444.
У хімії концентрація розчину показує, як багато розчиненого речовини міститься в розчиннику. Відповідно до стандартної формулою C = m / V, де C. концентрація, m. маса розчиненої речовини і V. загальний об’єм розчину. При малих концентраціях зручніше обчислювати концентрацію в мільйонних частках (ppm). Під час лабораторної роботи вас можуть попросити також обчислити молярність, або молярна концентрація розчину.
Порада: якщо необхідно використовувати ваги, відніміть із загальної маси масу ємності, в якій знаходиться зважувати рідина, щоб отримати правильний результат.
Порада: мільйонні частки зазвичай використовують для дуже малих концентрацій, коли легше записати і зрозуміти відповідь в них, а не у відсотках.
Порада: зазвичай немає необхідності враховувати обсяг розчиненої речовини, так як він, як правило, не сильно впливає на загальний обсяг. Однак якщо обсяг помітно зміниться після того, як ви додасте розчинна речовина, використовуйте загальний обсяг розчину.
Як вирішувати завдання з хімії, готові рішення
При вирішенні завдань необхідно керуватися декількома простими правилами:
- Уважно прочитати умову задачі;
- Записати, що дано;
- Перевести, якщо це необхідно, одиниці фізичних величин в одиниці системи СІ (деякі позасистемні одиниці допускаються, наприклад літри);
- Записати, якщо це необхідно, рівняння реакції і розставити коефіцієнти;
- Вирішувати завдання, використовуючи поняття про кількість речовини, а не метод складання пропорцій;
- записати відповідь.
З метою успішної підготовки з хімії слід уважно розглянути рішення задач, що приводяться в тексті, а також самостійно вирішити достатнє число їх. Саме в процесі вирішення завдань будуть закріплені основні теоретичні положення курсу хімії. Вирішувати завдання необхідно на протязі всього часу вивчення хімії і підготовки до іспиту.
Ви можете використовувати завдання на цій сторінці, а можете завантажити хороший збірник задач і вправ з рішенням типових і ускладнених завдань (М. І. Лебедєва, І. А. Анкудімова): завантажити.
Молярна маса. це відношення маси речовини до кількості речовини, тобто.
де М (х). молярна маса речовини Х, m (x). маса речовини Х, ν (x). кількість речовини Х. Одиниця СІ молярної маси. кг / моль, проте зазвичай використовується одиниця г / моль. Одиниця маси. г, кг. Одиниця СІ кількості речовини. моль.
Будь-яке завдання з хімії вирішується через кількість речовини. Необхідно пам’ятати основну формулу:
де V (x). обсяг речовини Х (л), Vm. молярний об’єм газу (л / моль), N. число часток, NA. постійна Авогадро.
Визначте масу йодиду натрію NaI кількістю речовини 0,6 моль.
Рішення. Молярна маса йодиду натрію становить:
Визначте кількість речовини атомного бору, що міститься в тетраборат натрію Na2B4O7 масою 40,4 г.
Рішення. Молярна маса тетрабората натрію становить 202 г / моль. Визначаємо кількість речовини Na2B4O7:
Згадаймо, що 1 моль молекули тетрабората натрію містить 2 моль атомів натрію, 4 моль атомів бору і 7 моль атомів кисню (див. Формулу тетрабората натрію). Тоді кількість речовини атомного бору одно: ν (B) = 4 ν (Na2B4O7) = 4 0,2 = 0,8 моль.
Розрахунки за хімічними формулами. Масова частка.
Масова частка речовини. відношення маси даної речовини в системі до маси всієї системи, тобто ω (Х) = m (Х) / m, де ω (X). масова частка речовини Х, m (X). маса речовини Х, m. маса всієї системи. Масова частка. безрозмірна величина. Її виражають в частках від одиниці або у відсотках. Наприклад, масова частка атомного кисню становить 0,42, або 42%, тобто ω (О) = 0,42. Масова частка атомного хлору в хлориде натрію становить 0,607, або 60,7%, тобто ω (Cl) = 0,607.
Визначте масову частку кристалізаційної води в дигідрат хлориду барію BaCl2 2H2O.
Рішення: Молярна маса BaCl2 2H2O становить:
М (BaCl2 2H2O) = 137 2 35,5 2 18 = 244 г / моль
З формули BaCl2 2H2O слід, що 1 моль дигидрата хлориду барію містить 2 моль Н2О. Звідси можна визначити масу води, що міститься в BaCl2 2H2O:
Знаходимо масову частку кристалізаційної води в дигідрат хлориду барію BaCl2 2H2O.
З зразка гірської породи масою 25 г, що містить мінерал аргентит Ag2S, виділено срібло масою 5,4 г. Визначте масову частку аргентиту в зразку.
Рішення: визначаємо кількість речовини срібла, що знаходиться в аргентит: ν (Ag) = m (Ag) / M (Ag) = 5,4 / 108 = 0,05 моль.
З формули Ag2S слід, що кількість речовини аргентиту в два рази менше кількості речовини срібла. Визначаємо кількість речовини аргентиту:
Тепер визначаємо масову частку аргентиту в зразку гірської породи, масою 25 г.
Визначте найпростішу формулу сполуки калію з марганцем і киснем, якщо масові частки елементів в цій речовині становлять відповідно 24,7, 34,8 і 40,5%.
Рішення: для розрахунків вибираємо масу сполуки, рівну 100 г, тобто m = 100 г. Маси калію, марганцю і кисню складуть:
Визначаємо кількості речовин атомних калію, марганцю і кисню:
Розділивши праву частину рівності на менше число (0,63) отримаємо:
Отже, найпростіша формула сполуки KMnO4.
При згорянні 1,3 г речовини утворилося 4,4 г оксиду вуглецю (IV) і 0,9 г води. Знайти молекулярну формулу речовини, якщо його щільність за воднем дорівнює 39.
Рішення: Припустимо, що шукане речовина містить вуглець, водень і кисень, тому що при його згорянні утворилися СО2 і Н2О. Тоді необхідно знайти кількості речовин СО2 і Н2О, щоб визначити кількості речовин атомарних вуглецю, водню і кисню.
Визначаємо кількості речовин атомарних вуглецю і водню:
Отже, маси вуглецю і водню дорівнюватимуть:
Визначаємо якісний склад речовини:
Отже, речовина складається тільки з вуглецю і водню (див. Умову задачі). Визначимо тепер його молекулярну масу, виходячи з даної в умові завдання щільності речовини за воднем.
Далі знаходимо відношення кількостей речовин вуглецю і водню:
Розділивши праву частину рівності на число 0,1, отримаємо:
Приймемо число атомів вуглецю (або водню) за «х», тоді, помноживши «х» на атомні маси вуглецю і водню і прирівнявши цю суму молекулярної маси речовини, вирішимо рівняння:
12х х = 78. Звідси х = 6. Отже, формула речовини С6Н6. бензол.
Молярний об’єм газів. Закони ідеальних газів. об’ємна частка.
Молярний об’єм газу дорівнює відношенню обсягу газу до кількості речовини цього газу, тобто.
де Vm. молярний об’єм газу. постійна величина для будь-якого газу за даних умов; V (X). обсяг газу Х; ν (x). кількість речовини газу Х. Молярний об’єм газів при нормальних умовах (нормальному тиску рн = 101 325 Па ≈ 101,3 кПа і температурі Тн = 273,15 К ≈ 273 К) становить Vm = 22,4 л / моль.
У розрахунках, пов’язаних з газами, часто доводиться переходити від даних умов до нормальних або навпаки. При цьому зручно користуватися формулою, наступної з об’єднаного газового закону Бойля-Маріотта і Гей-Люссака:
Де p. тиск; V. об’єм; Т- температура в шкалі Кельвіна; індекс «н» вказує на нормальні умови.
Склад газових сумішей часто висловлюють за допомогою об’ємної частки. відношення обсягу даного компонента до загального обсягу системи, тобто.
де φ (Х). об’ємна частка компонента Х; V (X). обсяг компонента Х; V. обсяг системи. Об’ємна частка. безрозмірна величина, її виражають в частках від одиниці або у відсотках.
Який обсяг займе при температурі 20 о С і тиску 250 кПа аміак масою 51 г?
Рішення: визначаємо кількість речовини аміаку:
Обсяг аміаку при нормальних умовах становить:
Використовуючи формулу (3), наводимо обсяг аміаку до даних умов [температура Т = (273 20) К = 293 К]:
Визначте обсяг, який займають при нормальних умовах газова суміш, яка містить водень, масою 1,4 г і азот, масою 5,6 г.
Рішення: знаходимо кількості речовини водню і азоту:
Так як при нормальних умовах ці гази не взаємодіють між собою, то обсяг газової суміші буде дорівнює сумі об’ємів газів, тобто.
Розрахунки за хімічними рівняннями
Розрахунки за хімічними рівняннями (стехиометрические розрахунки) засновані на законі збереження маси речовин. Однак в реальних хімічних процесах через неповне протікання реакції і різних втрат речовин маса продуктів, що утворяться часто буває меншою за ту, яка повинна утворитися відповідно до закону збереження маси речовин. Вихід продукту реакції (або масова частка виходу). це виражене у відсотках відношення маси реально отриманого продукту до його масі, яка повинна утворитися відповідно до теоретичним розрахунком, тобто.
Де η- вихід продукту,%; mp (X). маса продукту Х, отриманого в реальному процесі; m (X). розрахована маса речовини Х.
У тих завданнях, де вихід продукту не вказано, передбачається, що він. кількісний (теоретичний), тобто η = 100%.
Яку масу фосфору треба спалити для отримання оксиду фосфору (V) масою 7,1 г?
Рішення: записуємо рівняння реакції горіння фосфору і розставляємо стехіометричні коефіцієнти.
Визначаємо кількість речовини P2O5, отриманого в реакції.
З рівняння реакції слід, що ν (P2O5) = 2ν (P), отже, кількість речовини фосфору, необхідного в реакції одно:
В надлишку соляної кислоти розчинили магній масою 6 г і цинк масою 6,5 г. Який об’єм водню, виміряний за нормальних умов, виділиться при цьому?
8 клас. Масова частка розчиненої речовини. Вирішення задач.
Рішення: записуємо рівняння реакції взаємодії магнію і цинку з соляною кислотою і розставляємо стехіометричні коефіцієнти.
Визначаємо кількості речовин магнію і цинку, що вступили в реакцію з соляною кислотою.
З рівнянь реакції слід, що кількість речовини металу і водню рівні, тобто ν (Mg) = ν (Н2); ν (Zn) = ν (Н2), визначаємо кількість водню, отриманого в результаті двох реакцій:
Розраховуємо обсяг водню, що виділився в результаті реакції:
При пропущенні сірководню об’ємом 2,8 л (нормальні умови) через надлишок розчину сульфату міді (II) утворився осад масою 11,4 г. Визначте вихід продукту реакції.
Рішення: записуємо рівняння реакції взаємодії сірководню і сульфату міді (II).
Визначаємо кількість речовини сірководню, який бере участь в реакції.
З рівняння реакції слід, що ν (H2S) = ν (СuS) = 0,125 моль. Значить можна знайти теоретичну масу СuS.
Тепер визначаємо вихід продукту, користуючись формулою (4):
Яка маса хлориду амонію утворюється при взаємодії хлороводню масою 7,3 г з аміаком масою 5,1 г? Який газ залишиться в надлишку? Визначте масу надлишку.
Це завдання на «надлишок» і «недолік». Розраховуємо кількості речовини хлороводню і аміаку і визначаємо, який газ знаходиться в надлишку.
Аміак перебуває в надлишку, тому розрахунок ведемо через брак, тобто по хлороводню. З рівняння реакції слід, що ν (HCl) = ν (NH4Cl) = 0,2 моль. Визначаємо масу хлориду амонію.
Ми визначили, що аміак знаходиться в надлишку (за кількістю речовини надлишок становить 0,1 моль). Розрахуємо масу надлишку аміаку.
Технічний карбід кальцію масою 20 г обробили надлишком води, отримавши ацетилен, при пропущенні якого через надлишок бромної води утворився 1,1,2,2.тетраброметан масою 86,5 г. Визначте масову частку СаС2 в технічному карбіті.
Рішення: записуємо рівняння взаємодії карбіду кальцію з водою і ацетилену з бромної водою і розставляємо стехіометричні коефіцієнти.
Знаходимо кількість речовини Тетраброметан.
З рівнянь реакцій слід, що ν (C2H2Br4) = ν (C2H2) = ν (СаC2) = 0,25 моль. Звідси ми можемо знайти масу чистого карбіду кальцію (без домішок).
Визначаємо масову частку СаC2 в технічному карбіті.
Розчини. Масова частка компонента розчину
У бензолі об’ємом 170 мл розчинили сірку масою 1,8 г. Щільність бензолу дорівнює 0,88 г / мл. Визначте масову частку сірки в розчині.
Рішення: для знаходження масової частки сірки в розчині необхідно розрахувати масу розчину. Визначаємо масу бензолу.
У воді масою 40 г розчинили залізний купорос FeSO47H2O масою 3,5 г. Визначте масову частку сульфату заліза (II) в отриманому розчині.
Рішення: знайдемо масу FeSO4 міститься в FeSO47H2O. Для цього розрахуємо кількість речовини FeSO47H2O.
З формули залізного купоросу слід, що ν (FeSO4) = ν (FeSO47H2O) = 0,0125 моль. Розрахуємо масу FeSO4:
З огляду на, що маса розчину складається з маси залізного купоросу (3,5 г) і маси води (40 г), розрахуємо масову частку сульфату заліза в розчині.
Завдання для самостійного рішення
- На 50 г йодистого метилу в гексані подіяли металевим натрієм, при цьому виділилося 1,12 л газу, виміряного при нормальних умовах. Визначте масову частку йодистого метилу в розчині. Відповідь: 28,4%.
- Деякий спирт піддали окислення, при цьому утворилася одноосновная карбонова кислота. При спалюванні 13,2 г цієї кислоти отримали вуглекислий газ, для повної нейтралізації якого треба було 192 мл розчину КОН з масовою часткою 28%. Щільність розчину КОН дорівнює 1,25 г / мл. Визначте формулу спирту. Відповідь: бутанол.
- Газ, отриманий при взаємодії 9,52 г міді з 50 мл 81% розчину азотної кислоти, щільністю 1,45 г / мл, пропустили через 150 мл 20% розчину NaOH густиною 1,22 г / мл. Визначте масові частки розчинених речовин. Відповідь: 12,5% NaOH; 6,48% NaNO3; 5,26% NaNO2.
- Визначте обсяг виділилися газів при вибуху 10 г нітрогліцерину. Відповідь: 7,15 л.
- Зразок органічної речовини масою 4,3 г спалили в кисні. Продуктами реакції є оксид вуглецю (IV) об’ємом 6,72 л (нормальні умови) і вода масою 6,3 г. Щільність парів вихідної речовини за воднем дорівнює 43. Визначте формулу речовини. Відповідь: С6Н14.
Головна »ЄДІ. хімія для чайників »Як вирішувати завдання з хімії, готові рішення
Розрахунок масової або об’ємної частки виходу продукту реакції від теоретично можливого
Багато хімічних реакцій є оборотними, вони відбуваються не до кінця, тобто не відбувається повного перетворення вихідних речовин в кінцевий продукт. Навіть якщо реакція необоротна, то все одно при її здійсненні відбувається втрата речовин. В результаті практично отримане кількість продукту реакції становить лише частину від теоретично можливої маси.
Вихід продукту реакції від теоретично можливого (η). це відношення маси (обсягу, кількості) реально отриманого речовини до його теоретично можливої масі (об’єму, кількості), яке розраховується за рівнянням хімічної реакції:
Завдання 1. Обчислити масову частку виходу (у відсотках) чистого вольфраму від теоретично можливого, якщо з 10.1 кг оксиду вольфраму (VI) отримано після відновлення воднем 7.5 кг вольфраму.
1) Знаходимо з рівняння реакції теоретичну масу вольфраму:
2) Обчислюємо масову частку виходу вольфраму від теоретично можливого.
Практичний вихід вольфраму дан в умові завдання: m_практ. (W) = 7.5 кг.
Відповідь: масова частка виходу вольфраму від теоретично можливого дорівнює 94%.
Завдання 2. Розрахуйте масу вступило в реакцію бензолу, якщо утворилося 9.8 г нітробензолу, а масова частка виходу продукту дорівнює 80% від теоретично можливого.
1) Знаходимо за формулою η = / теоретичну масу нитробензола:
2) Визначаємо масу бензолу за рівнянням реакції:
Завдання 3. Обчислити обсяг оксиду сірки (IV), який необхідно взяти для реакції з киснем, щоб отримати 20г оксиду сірки (VI), якщо вихід продукту реакції дорівнює 80% від теоретично можливого.
Знаходимо за формулою η = / теоретичну масу оксиду сірки (IV):
Визначаємо кількість речовини оксиду сірки (VI):
З рівняння реакції 2SO_2 O_2 = 2SO_3 слід, що ν (SO_2) / ν (SO_3) = 2/2.
Обчислимо обсяг оксиду сірки (IV): ν (SO_2) = V_м V (SO_2); V (SO_2) = 22.4 0.31 = 7 л.
Розрахунок маси (обсягу, кількості речовини) продуктів реакції, якщо одне з речовин дано в надлишку (має домішки)
Завдання 1. Який обсяг повітря (н.у.) знадобиться для взаємодії з 270 г алюмінію, що містить 20% домішок? Яка кількість речовини оксиду алюмінію при цьому вийде?
4Al↖216г3O_2↖ = 2Al_2O_3↖, де x. обсяг кисню V (O_2), y. кількість речовини оксиду алюмінію ν (Al_2O_3).
Однак в задачі потрібно знайти об’єм не кисню, а повітря. У повітрі міститься 21% кисню за об’ємом. Перетворюючи формулу φ = /, знайдемо об’єм повітря:
б) 216/108 = / 2; y = 216 2/108 = 4 моль. кількість речовини оксиду алюмінію n (Al_2O_3).
Визначення складу суміші, якщо її компоненти вибірково взаємодіють із зазначеними реагентами
Завдання 1. 10 г суміші порошків міді та алюмінію обробили надлишком розчину лугу, виділилося 3.4 л газу (н. У.). Визначте склад суміші в масових частках.
З лугом взаємодіє тільки алюміній:
Молярне співвідношення алюмінію і водню дорівнює 2: 3.
Визначимо масу алюмінію: m (Al) = ν (Al) M (Al) = 0.1 моль 27 г / моль = 2.7 г.
Визначимо масову частку алюмінію в суміші:
Визначимо масову частку міді в суміші:
відповідь: масові частки металів у суміші ω (Al) = 27%, ω (Cu) = 73%.
Завдання 2. 14 г суміші ароматичного вуглеводню. гомолога бензолу і фенолу обробили бромной водою. При цьому випало 33,1 г осаду. Визначте структуру вуглеводню, якщо його кількість в вихідної суміші одно
Розрахунок маси (обсягу, кількості речовини) продукту реакції, якщо одне з речовин дано у вигляді розчину з певною масовою часткою розчиненої речовини
Завдання 1. Який об’єм водню (н.у.) виділиться при взаємодії 730 г 30%.ної соляної кислоти з необхідним по реакції кількістю речовини цинку? Яке це кількість речовини?
де x. кількість речовини цинку n (Zn), y. обсяг водню V (H_2).
.05 моль. Обчисліть масові частки компонентів в суміші.
З бромной водою в суміші реагує тільки фенол:
Визначимо кількість осаду (C_6H_2Br_3OH):
M (C_6H_2Br_3OH) = 331 г / моль; M (C_6H_5OH) = 94 г / моль.
m (C_6H_5OH) = ν (C_6H_5OH) M (C_6H_5OH) = 0.1 моль 94 г / моль = 9.4 г.
Визначимо масу ароматичного вуглеводню, склад якого виражається формулою С_Н_2n-6:
Обчислимо молярну масу вуглеводню:
Тепер потрібно визначити значення n у формулі С_Н_2n-6. Очевидно, що молярна маса дорівнює:
Прирівняємо праві частини рівностей (3) і (4):
Визначимо формулу вуглеводню і масові частки компонентів в суміші.
відповідь: масова частка фенолу в суміші 67%, ароматичного вуглеводню. 33%.
Теорія до завдання 34 з ЄДІ з хімії
Визначення складу суміші, якщо всі її компоненти взаємодіють з даними реагентом
Завдання 1. Суміш магнію і заліза масою 8 г обробили надлишком соляної кислоти. В результаті реакції виділилося 4.5 л водню (н.у.). Яка маса кожного металу перебувала в суміші?
Позначимо масу одного компонента, наприклад, магнію. х, m (Mg) = х г, тоді m (Fe) = (8. X) м Визначимо кількість речовини в суміші:
З рівнянь (1) і (2) визначимо, що кількість водню, що виділився в реакціях, дорівнює кількості металів, що вступили в реакцію:
З огляду на рівності (3) і (4), складемо рівняння:
Оскільки кількість водню, що виділився в реакціях (1) і (2), так само
Розрахунок масової частки (маси) хімічної сполуки в суміші
Найпоширенішими серед розрахункових завдань в хімії є завдання на суміші речовин. Кожна суміш складається з двох або більше компонентів, склад сумішей може змінюватися в широких межах. Рішення задач на суміші зазвичай зводиться або до визначення складу суміші за даними наведеними в умові завдання, або до розрахунку кількості реагентів або продуктів реакції щодо участі в суміші відомого складу.
Склад суміші може виражатися різними способами:
- можна вказати маси кожного компонента;
- можна визначити кількість (число моль) компонентів;
- можна вказати масові частки компонентів. Масова частка компонента Х в суміші дорівнює:
4) в разі суміші газів можна вказати обсяги газів, складових суміш, або об’ємні частки цих газів. Об’ємна частка газу Х в суміші дорівнює:
.2 моль і дорівнює загальній кількості Mg і Fe, можна позначити через х кількість одного з металів, наприклад магнію:
відповідь: склад суміші m (Mg) = 2,4 г; m (Fe) = 5.6 г.
Завдання 2. При повному термічному розкладанні 6.6 г суміші перманганату калію і нітрату натрію виділилося
Розрахунки масової частки хімічної сполуки в суміші (частина С)
.7 л кисню (н. У.). В якому молярної співвідношенні були взяті вихідні компоненти?
Роль «реагенту» в цьому завданні виконує нагрівання. Для вирішення завдання необхідно згадати, які продукти утворюються при нагріванні KMnO_4 і NaNO_3.
Визначимо загальна кількість кисню:
З рівнянь (1) і (2) сумарна кількість KMnO_4 і NaNO_3 в два рази більше, ніж кількість кисню:
ν (KMnO_4) ν (NaNO_2) = 2 ν (O_2) = 2 0.03 моль = 0.06 моль.
Сума мас KMnO_4 і NaNO_3 дорівнює масі суміші:
Визначимо молярное співвідношення вихідних компонентів суміші:
відповідь: вихідні компоненти суміші знаходяться в співвідношенні ν (KMnO_4) / ν (NaNO_3) = 1: 2.
Визначення складу суміші з невідомої масою
Завдання. При обробці суміші гідроксиду калію і гідрокарбонату калію надлишком соляної кислоти утворилося 59.6 г хлориду калію і виділилося 4.5 л газу (н. У.). Визначте масову частку гідрокарбонату калію у вихідній суміші.
KOH і KHCO_3 взаємодіють з соляною кислотою і утворюють KCl.
Визначаємо загальну кількість KCl в реакціях (1) і (2) і кількість СО_2, що виділився в реакції (2):
З рівняння (2) кількість і маса KHCO_3 в суміші рівні:
m (KHCO_3) = ν (KHCO_3) M (KHCO_3) = 0.2 моль 100 г / моль = 20 г.
Визначимо кількість KCl, що утворився в реакціях (2) і (1):
Визначимо кількість KOH з рівняння (1) і масу KOH:
Обчислимо масу суміші: m (суміші) = m (KOH) m (KHCO_3) = 33.6 г 20 г = 53.6 г.
Визначимо масову частку KHCO_3 в суміші:
відповідь: масова частка гідрокарбонату калію в суміші дорівнює 37.3%.
Рішення задач на суміші, якщо їх компоненти мають однакові молярні маси
Завдання. До суміші карбонату кальцію і гідрокарбонату калію масою 20 г додали надлишок соляної кислоти. Утворився газ пропустили через надлишок баритовой води. Визначте масу утворився при цьому осаду.
В умові задачі вказана загальна маса суміші, але не вказано її складу. Зверніть увагу на те, що в задачі не потрібно визначити склад суміші. В даному випадку склад суміші не має m (осаду).? значення, і за даними, наведеними в умові, не може бути визначений. Справа в тому, що СаСО_3 і KHCO_3 мають однакову молярну масу:
Визначимо сумарну кількість моль компонентів суміші:
Молярні співвідношення між СаСО_3 і СО_2, а також між KHCO_3 і СО_2 однакові:
Визначимо загальна кількість СО_2, що виділився в першій і в другій реакціях:
Оксид вуглецю (IV) при взаємодії з баритовой водою утворює нерозчинний карбонат барію: CO_2 Ba (OH) _2 = BaCO_3 H_2O. (3)
Визначимо кількість речовини карбонату барію:
Обчислимо масу осаду: M (BaCO_3) = 197 г / моль
m (BaCO_3) = m (BaCO_3) M (BaCO_3) = 0.2 моль 197 г / моль = 39.4 г.
відповідь: маса утвореного осаду дорівнює 39.4 г.